食品二級品管驗證
方案介紹
衛生福利部食品藥物管理署為加強對食品工廠的管理,於103年11月7日公告「食品業者衛生安全管理驗證及委託驗證管理辦法」,要求經中央主管機關公告業別及規模之食品業者,須強制接受二級品管(第三方驗證)到廠實地查核,查驗工廠於食品製程的安全性,以維護國人飲食健康。
https://www.fda.gov.tw/TC/site.aspx?sid=7886
https://www.fda.gov.tw/TC/site.aspx?sid=11234&r=330074358

聯絡窗口:技服組施立芳小姐(分機259)電話:02-26101010
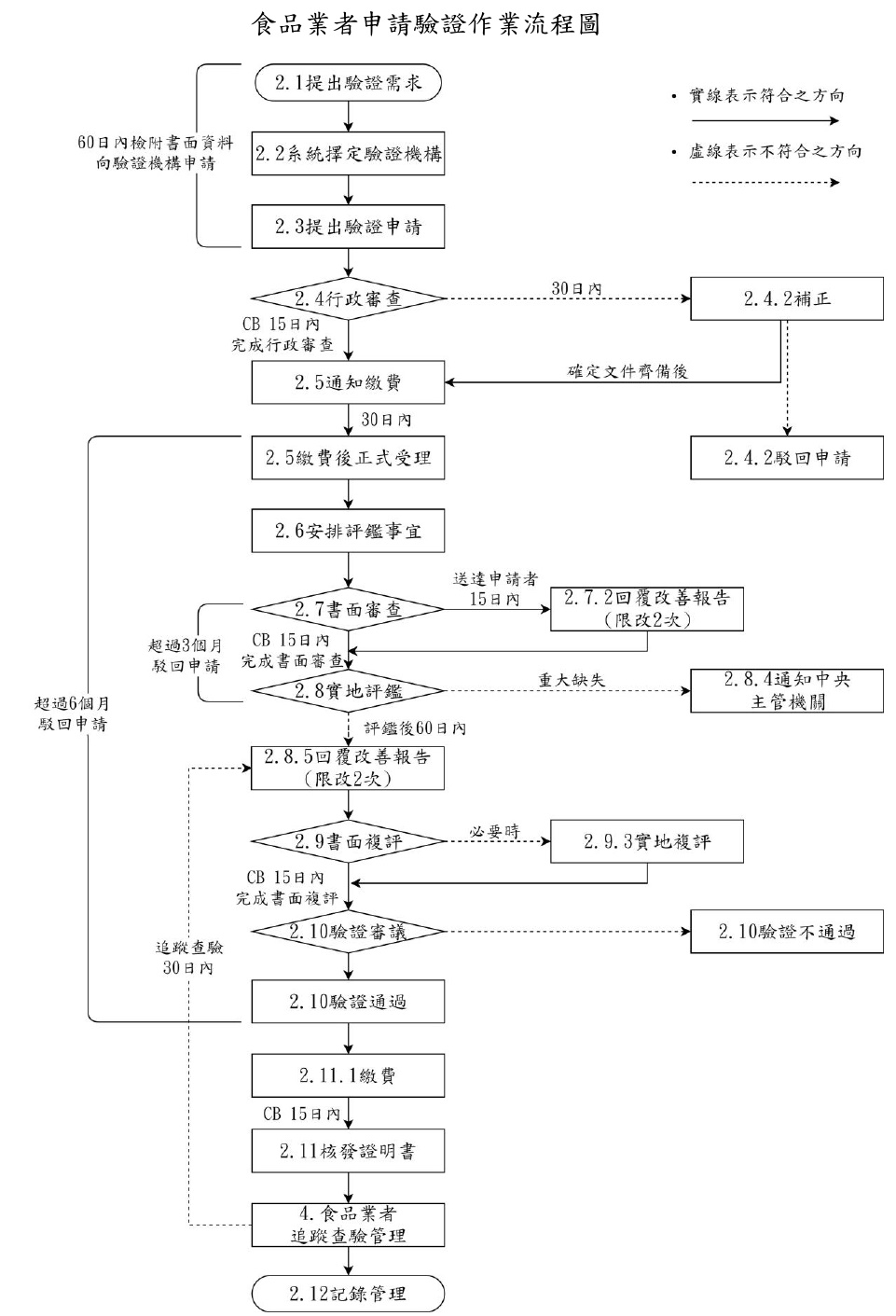
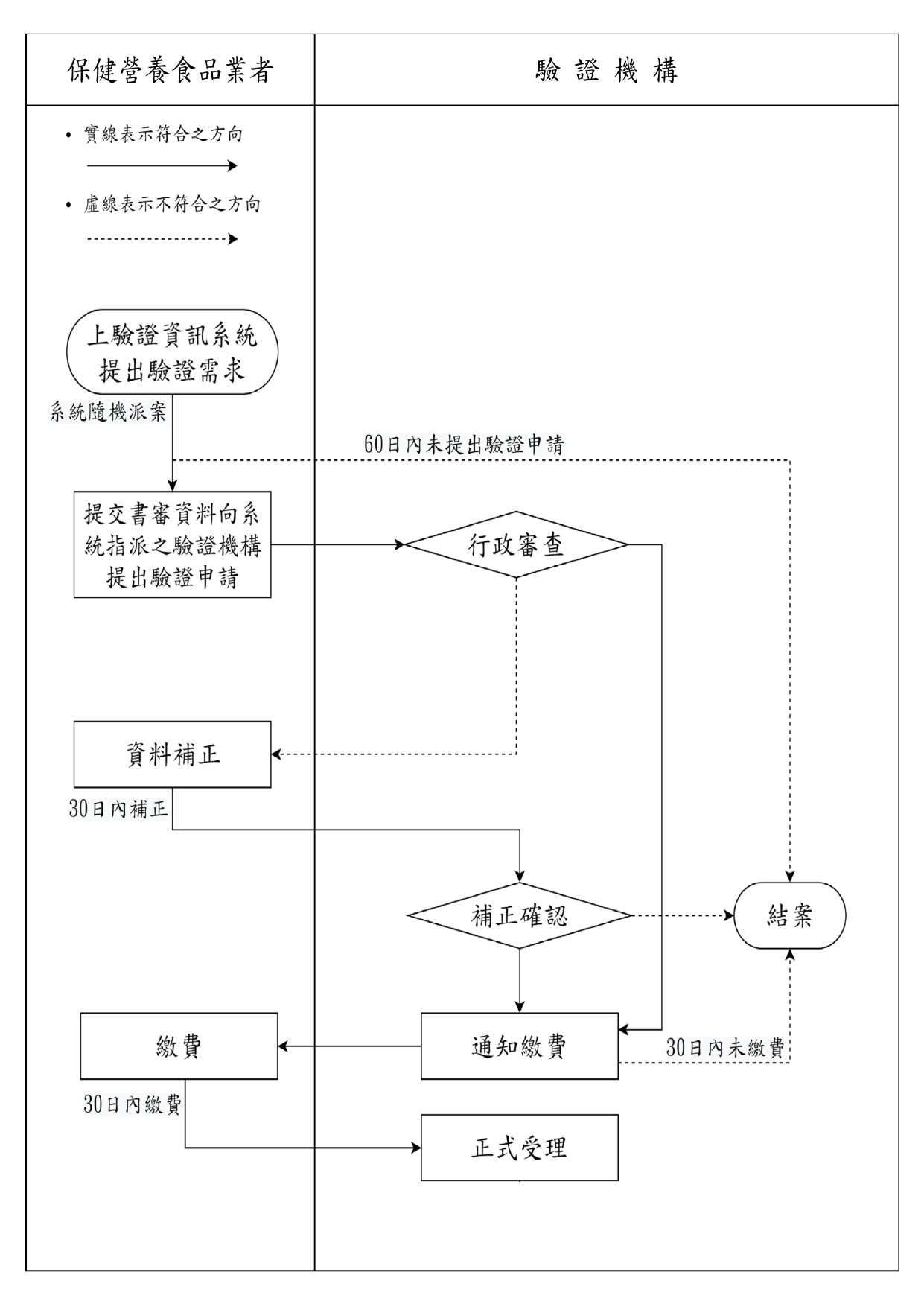
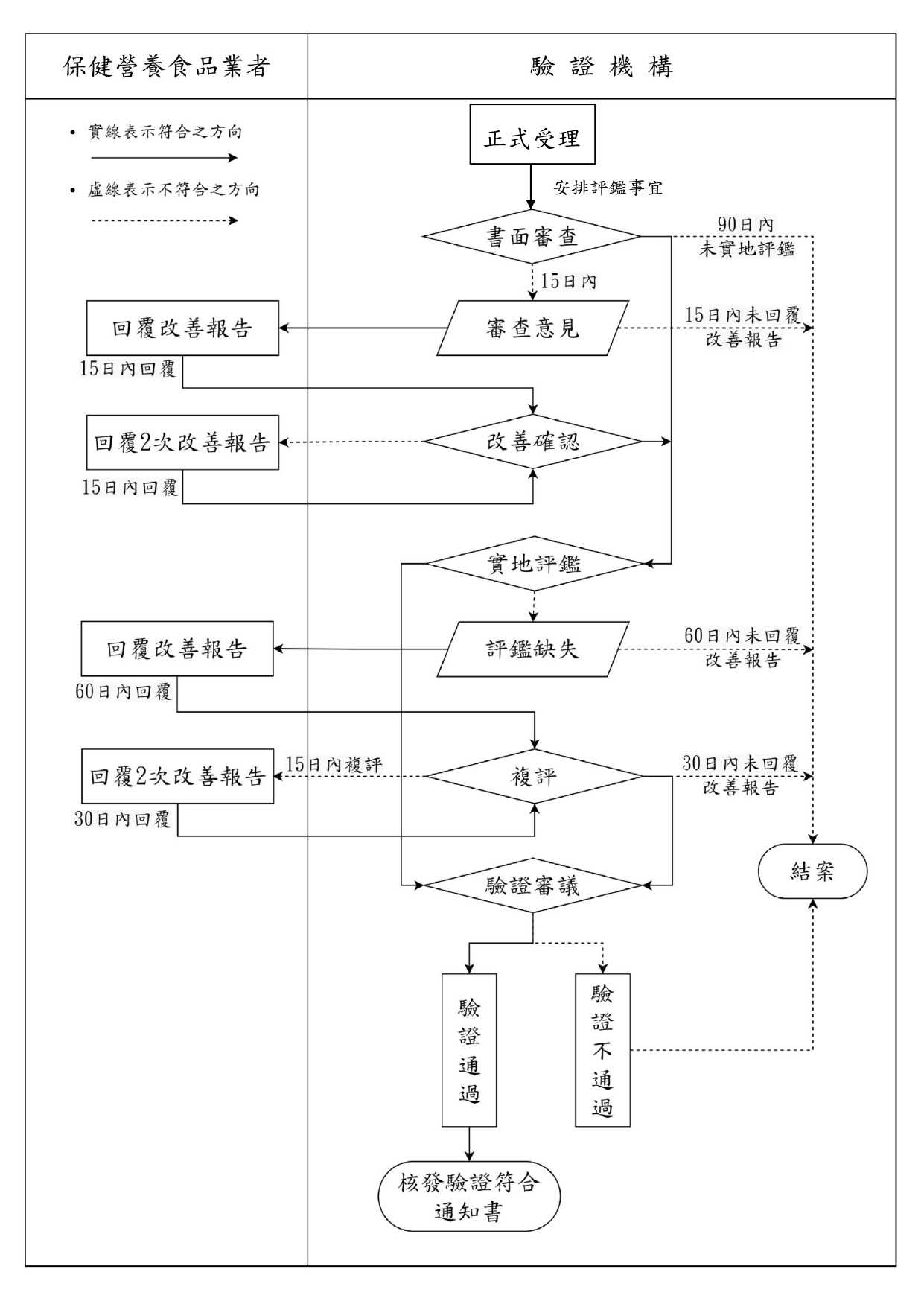
驗證作業流程
收費標準
1. 收費項目
收費項目分為驗證申請費、實地評鑑費、追蹤查驗費、證書費、驗證範圍增加食品安全管制系統準則業別與保健營養食品GMP驗證費用等。
2. TFDA二級品管驗證收費標準
| 收費項目 | 費用 | 備註 |
| 驗證申請費 | 新台幣24,000元/件 | |
| 實地評鑑 | 見3.驗證實地評鑑費用表 | 新台幣18,000元/人天,人天數為無條件進位。 |
| 追蹤查驗 | 見4.追蹤查驗費用表 | |
| 證書費 | 發證、換發:新台幣3,000元/件 | |
| 加發:新台幣2,000元/件 | 加發證明書或英文證明書 | |
| 驗證範圍增加食品安全管制系統準則業別 | 見5.驗證範圍增加食品安全管制系統準則業別驗證費用表 | |
| 保健營養食品GMP驗證 | 見6.保健營養食品GMP驗證收費說明 |
3. 驗證實地評鑑費用表
| 食品製造業類別數 | |||||
| 1 | 2~3 | 4~7 | 8以上 | ||
| 食品安全管制系統準則業別數 | 0 | 36,000 | 36,000 | 54,000 | 72,000 |
| 1 | 36,000 | 54,000 | 72,000 | 90,000 | |
| 2 | - | 72,000 | 90,000 | 108,000 | |
| 3 | - | 90,000 | 108,000 | 126,000 | |
| 4 | - | - | 126,000 | 144,000 | |
3.2食品安全管制系統準則業別數:指驗證場所內包含公告應符合食品安全管制系統準則之業別數量。
3.3食品安全管制系統準則業別數為0,係指業者申請之驗證範圍內並無經公告需符合食品安全管制系統準則之業別,僅需驗證食品良好衛生規範準則。
3.4範例說明:
(1)某甲工廠其申請之驗證範圍僅有食品添加物,則其食品製造業類別數為1,食品安全管制系統準則業別數為0,其實地評鑑費用為36,000元。
(2)某乙工廠其申請之驗證範圍為食品添加物及乳品製造業,則其食品製造業類別數為2,食品安全管制系統準則業別數為1,其實地評鑑費用為54,000元。
4. 追蹤查驗費用表
| 食品製造業類別數 | |||||
| 1 | 2~3 | 4~7 | 8以上 | ||
| 食品安全管制系統準則業別數 | 0 | 18,000 | 18,000 | 27,000 | 36,000 |
| 1 | 18,000 | 27,000 | 36,000 | 45,000 | |
| 2 | - | 36,000 | 45,000 | 54,000 | |
| 3 | - | 45,000 | 54,000 | 63,000 | |
| 4 | - | - | 63,000 | 72,000 | |
4.2食品安全管制系統準則業別數:指驗證場所內包含公告應符合食品安全管制系統準則之業別數量。
4.3食品安全管制系統準則業別數為0,係指業者申請之驗證範圍內並無經公告需符合食品安全管制系統準則之業別,僅需驗證食品良好衛生規範準則。
4.4範例說明:
(1)某甲工廠其申請之驗證範圍僅有食品添加物,則其食品製造業類別數為1,食品安全管制系統準則業別數為0,其實地評鑑費用為18,000元。
(2)某乙工廠其申請之驗證範圍為食品添加務及乳品製造業,則其食品製造業類別數為2,食品安全管制系統準則業別數為1,其實地評鑑費用為27,000元。
5. 驗證範圍增加食品安全管制系統準則業別驗證費用表
| 增加食品安全管制系統準則業別數* | 費用 |
|---|---|
| 1 | 36,000 |
| 2 | 54,000 |
| 3 | 72,000 |
| 4 | 90,000 |
6. 保健營養食品GMP驗證收費說明
6.1本保健營養食品GMP驗證為搭配食品衛生安全管理系統驗證作業進行,不進行單獨驗證(若是該驗證客戶已完成食品衛生安全管理系統驗證作業者則例外,可另外進行本保健營養食品GMP驗證)。
6.2實地評鑑時,客戶應擇定各類產品型態中製程最具代表性之產品生產。保健營養食品GMP驗證產品型態分類及申請產品型態分類如下:
| 分類1 | 懸液狀、溶液狀 |
| 分類2 | 糖衣狀、膜衣狀、錠狀、顆粒狀、散狀 |
| 分類3 | 軟膠囊狀 |
| 分類4*1 | 膠囊狀 |
| 分類5*1 | 其它 (請自行列舉中英文產品型態名稱) |
備註*2:申請其它產品型態者,應逐項載明其類別,且每個類別分計驗證所需人天。
6.3本保健營養食品GMP驗證基本人天數為2人天(僅申請1類產品型態),其後每增加1類產品型態增加1人天,人天數增加如下表。
| 產品型態分類數量* | 驗證人天數(A) | 單一產品型態分類之產品品項數量** | 驗證人天數(B) |
|---|---|---|---|
| 1 | 2人天 | 1~5 | 0人天 |
| 2 | 3人天 | 6~10 | 1人天 |
| 3 | 4人天 | 11~15 | 2人天 |
| 4 | 5人天 | 16~20 | 3人天 |
| 5 | 6人天 | 21~25 | 4人天 |
| 26~30 | 5人天 |
**單一分類之產品品項數量大於30時,驗證人天數依此類推,即單一分類每增加5個產品品項,則增加1人天。
備註1:總人天數 = 驗證人天數(A) 加上 驗證人天數(B)。
備註2:技術專家及見習稽核員不列入人天數計算。
備註3:驗證機構得視需要增加人天數,如有調整收費應與食品業者達成共識,並有書面紀錄。
7.收費方式
7.1驗證申請:客戶提交申請資料並經本組審查通過後正式受理,由本組通知申請客戶繳交驗證申請費用。
7.2實地評鑑:實地評鑑費用由行政人員於案件正式受理後,向客戶開立繳費通知單。
7.3複評:複評階段不另收取費用。
7.4驗證證明書:實地評鑑後通過驗證決定之客戶,則由行政人員開立證書費,並通知客戶繳費,待客戶繳費用方可寄發新證書,並納入追蹤系統。
7.5追蹤查驗:追蹤查驗費用由行政人員於安排追蹤查驗時,向客戶開立繳費通知單。
7.6變更:若驗證範圍增加HACCP業別時,僅針對新增業別執行驗證,費用見5.。
7.7食品衛生安全管理系統驗證不另收取交通費用及住宿費用。
7.8因颱風、天災、不可抗力或不可歸責於本所之因素,致無法完成稽核或定期追查,本所得依規定酌收已發生費用。
7.9合併驗證收費:書審費合併以一家計,實地評鑑費用一個廠之業別數相加後對照3.實地評鑑費用表計算收費,追蹤查驗以合併業別後之業別數對照4.定期追蹤查驗費用表計算收費,驗證證明書不合併計算。
7.10當驗證效期後申請展延且依舊是合併驗證的狀態下,則書審費仍合併以一家計,實地評鑑費用以合併業別後之業別數對照3.實地評鑑費用表計算收費,追蹤查驗以合併業別後之業別數對照4.期追蹤查驗費用表計算收費,驗證證書仍不合併計算。
7.11現場稽核費計算方式
7.11.1每日作業時間為上午9時至下午5時。超過2小時未滿4小時以半天計,超過4小時以一天計。
7.11.2若配合客戶需求,於下午5時後或例假日進行現場稽核作業,每4小時以一天計,未滿4小時以4小時計。
7.11.3上述各項費用皆以新台幣計算,聯絡人將發函通知客戶繳費,繳費後並由會計室開立收據給客戶;已認可登錄客戶未按規定繳納費用,經聯絡人通知限期催繳,逾期未繳者,廢止認可登錄。
8.繳費方式
8.1即期支票
將支票交予本組。抬頭請開立「財團法人中華榖類食品工業技術研究所」,以掛號郵寄本所出納。
8.2匯票
將匯票交予本組。抬頭請開立「財團法人中華榖類食品工業技術研究所」,以掛號郵寄本所出納。
8.3電匯
請匯款至華南商業銀行營業部
解(受)款行代號:0081005;收款人帳號:1001-6017-6901
收款人戶名:財團法人中華榖類食品工業技術研究所
8.4郵政劃撥
請劃撥至「財團法人中華榖類食品工業技術研究所」。
帳號:0566-6886
申請文件
連結網址:https://www.fda.gov.tw/TC/site.aspx?sid=7888
通過驗證客戶
連結網址:https://facs.fda.gov.tw/Page/FoodIndustry.aspx?v=57763601
撤銷或廢止名單
| 發函日期 | 客戶名稱 | 食品業者登錄字號 | 撤銷或廢止 | 撤銷或廢止理由 | 證書證號 | 證書效期 |
|---|---|---|---|---|---|---|
| 2025/2/10 | 信榮工業原料有限公司 | E-175459703-00001-3 | 廢止 | 工廠歇業 | 112-CB002-0013 | 112年5月22日至115年5月21日止 |
| 2025/5/16 | 鴻盛食品廠股份有限公司 | N-159885603-00001-6 | 廢止 | 工廠歇業 | 112-CB002-0035 | 112年7月7日至115年7月6日止 |
保健營養食品GMP驗證
連結網址:https://www.fda.gov.tw/TC/siteContent.aspx?sid=11234
保健營養食品GMP驗證補充說明
案例1:申請產品型態分類與人天計算
| 首次驗證 | 追蹤查驗 | |
|---|---|---|
| 產品型態分類(產品項數)/總人天 | 懸液狀(2)、糖衣狀(6)、軟膠囊狀(1)、其他-茶包(9)、其他-果凍(5)/8人天 *(A)產品型態計有5種,計為6人天 *(B)產品項數懸液狀(2)、糖衣狀(6)、軟膠囊狀(1)、其他-茶包(9)、其他-果凍(5):懸液狀、軟膠囊狀及果凍,各別產品項數小於5項,不額外增加人天數;糖衣狀(6)產品項數範圍於6~10,增加1人天:其他-茶包(9):產品項數範圍於6~10,增加1人天,共計增加2人天 |
追蹤查驗人天為首次驗證1/2人天,故追蹤查驗為4人天 |
| 驗證效期 | 與二級品管證明書一致 | 與二級品管證明書一致 |
案例2:僅增加原申請產品型態產品項數人天計算(與原申請之產品型態相同時)
| 首次驗證 | 追蹤查驗 | |
|---|---|---|
| 產品型態分類(產品項數)/總人天 | 懸液狀(2)、糖衣狀(2)、軟膠囊狀(3)/4人天 | 原追蹤查驗:懸液狀(2)、糖衣狀(2)、軟膠囊狀(3)/2人天 產品項數異動:軟膠囊狀為8項,增加1人天 追蹤查驗總人天為3人天 產品項數異動:懸液狀6項(1人天)、糖衣狀11項(2人天),增加3人天 追蹤查驗總人天為5人天 同分類新增產品於實地評鑑前須審查書面資料,並請業者更新產品清單。 |
| 驗證效期 | 與二級品管證明書一致 | 與二級品管證明書一致 |
案例3:業者於驗證效期期間增加產品型態之人天
| 首次驗證 | 追蹤查驗 | ||
|---|---|---|---|
| 增項 | 定期追蹤查驗 | ||
| 產品型態分類(產品項數)/總人天 | 懸液狀(2)、糖衣狀(2)、軟膠囊狀(3)/4人天 | 增項膠囊狀(3)/2人天 |
追蹤查驗人天為首次驗證1/2人天,懸液狀(2)、糖衣狀(2)、軟膠囊狀(3)、膠囊狀(3),產品型態計有4種分類,故追蹤查驗為2.5人天,且新增產品型態分類須進行書面審查。 |
| 驗證效期 | 與二級品管證明書一致 | 與二級品管證明書一致 | |
案例4:業者於追蹤查驗時同時增加產品型態之人天(與原申請之產品型態不相同時)
| 首次驗證 | 追蹤查驗 | |
|---|---|---|
| 產品型態分類(產品項數)/總人天 | 懸液狀(2)、糖衣狀(2)、軟膠囊狀(3)/4人天 | 懸液狀(2)、糖衣狀(2)、軟膠囊狀(3)/2人天,新增1分類的膠囊狀(3)產品型態(基本為2人天),故追蹤查驗人天為4人天,且新增產品型態分類須進行書面審查。 |
| 驗證效期 | 與二級品管證明書一致 | 與二級品管證明書一致 |
一、變更申請
1. 通過驗證之食品業者有下列事項變更時,應自事實發生之次日起15日內,檢具「保健營養食品GMP驗證申請書表」,向本所申請變更:
(1) 公司名稱及負責人。
(2) 工廠名稱。
(3) 工廠地址。
(4) 驗證產品型態。
(5) 出口產品清單。
2. 前款(1)及(2)變更時,本所得視需要辦理實地評鑑。
3. 第1款(3)變更時,應依「保健營養食品GMP驗證申請須知」第三點第一項第2款辦理重新驗證。但因門牌整編或行政區域調整致工廠地址變更者,不在此限。
4. 第1款(4)新增時,本所依規定進行實地評鑑。
5. 第1款(5)新增時,食品業者應向本所進行核備。
6. 變更後重新換發驗證符合通知書,其驗證有效日期與原驗證符合通知書相同。
二、終止驗證資格
1. 食品業者因故不維持保健GMP驗證,自願辦理廢止驗證者,應於事實發生之次日起15日內,向本所機構提出申請。
2. 通過驗證之食品業者,有下列情形之一者,得由本所或TFDA命本所終止其驗證資格:
(1) 第二級品管經撤銷或廢止。
(2) 違反本指引,經本所通知限期改善而屆期未改善者。
(3) 相同缺失重複出現達2次以上,且影響產品品質。
(4) 規避、妨礙或拒絕本所之追蹤查驗或TFDA安排之見證評鑑。
(5) 違反「保健營養食品GMP驗證申請須知」第三點(三)之標示、宣傳或廣告規定。
Q12: 條文 1.3.1 要求保健營養食品需依據 經驗進行系統性檢討,但如為新設立 之工廠,尚未有足夠累積批次進行產品趨勢分析,應如何處理?
A12: 產品趨勢分析需要較多批次的累積才可進行,新廠如無相關累積批次,應於正式生產 累積足夠批次後,進行產品趨勢分析。
Q14: 只有指標成分須經檢驗確認含量,還是所有原料皆須經過檢驗?
A14:
1.依本指引條文 1.4.5 規範「標示於產品包裝之營養素或特定成分,若宣稱為指標成分, 應列為品管項目,並在容器包裝上明確標示其含量」,爰指標成分應透過檢驗確認其含量,並依條文 1.4.3,其檢驗方法需為主管機關公告、國際公認或其他經確效的方法。
2.另,本指引條文 5.17 及 5.18 規範天然物原料及原料之規格,包含應進行適當之檢驗, 並有其檢驗程序,除指標成分外並未強制各成分皆須檢驗其含量,惟,有關成分含量 最終標示原則應符合「包裝食品營養標示應遵行事項」及「包裝維生素礦物質類之錠 狀膠囊狀食品營養標示應遵行事項」之相關規定。
3.其他原料應依食品安全監測計畫進行強制檢驗。
Q16: 條文 1.4.5「標示於產品包裝之營養素 或特定成分,若宣稱為指標成分,應列 為品管項目,並在容器包裝上明確標示其含量。」其中,含量可否用計算的方式?
A16: 標示之含量應有成品檢驗報告作為佐證,不得僅用計算方式作為含量標示唯一依據。
Q18: 「包裝食品營養標示應遵行事項」附表訂有「營養標示值誤差允許範圍」, 請問業者指標成分的廠內放行(允收) 標準是否可低於標示之指標成分含 量? 如含量標示為一區間,放行(允收) 標準是否要高於區間最高值?
A18: 為確保產品於市售期間指標成分之含量符合標準規定,考量市售期間可能增加誤差範圍,指標成分之含量放行標準不應低於外包裝之標示值。如含量標示為一區間,廠內放行標準應於標示區間內。
Q40: 條文 6.54「離開生產線之取樣產品不 得放回生產線」,是否也包括線上取樣 之產品?
A40: 離開該產品包裝線之取樣樣品,不得放回包裝線。但如在包裝線上的作業區將產品拿 取查檢、秤重等,未離開該包裝作業區且不影響產品品質之虞,得放回包裝線。
Q41: 產品上市前之安定性試驗,是否可依 「市售包裝產品之有效期限評估指 引」或用間接方式評估效期?
A41: 「市售包裝產品有效日期評估指引」主要係提供一般食品評估其有效期限,以確保產 品在有效期限內無變質、腐敗或其他違反法規之事宜。而保健營養食品上市前進行之 安定性試驗,應依據本指引 7.34 「有關安定性試驗評估之必要條件,可參考主管機關 訂定之健康食品安定性試驗指引」,係包含確認其指標成分於預定儲存條件下,在有效 期限內之含量是否達規格要求,與「市售包裝產品有效日期評估指引」之目的不同, 故申請 GMP 驗證時,需有安定性試驗資料。
Q42: 產品的效期若已由安定性試驗而來, 持續安定性試驗是否還須持續進行?
A42:
1.持續安定性試驗計畫之目的係於產品上市後,監督產品存放適當條件下,於有效日期 內能符合產品規格,並持續監測任何與安定性相關之問題,並非用於評估及訂定有效 日期,與上市前之安定性試驗目的不同。 2.持續安定性試驗於本指引尚非強制辦理項目,故是否執行持續安定性試驗計畫應由 業者自行依外銷國家之規定進行,惟業者仍須自主監控其產品。
Q43: 持續安定性試驗,是針對業者留樣的 部分做檢驗確認,還是針對市售品抽樣?
A43: 依條文 7.29,持續安定性試驗之批次數及頻率係針對製造之每一含量及每一直接包裝 型態之產品於每年至少有一批次進行留樣,並於每年(第 12、24 個月…)取出檢驗,其 檢驗頻率亦可與安定性試驗之長期試驗相同,依持續安定性試驗計畫進行相關檢測, 非針對市售品抽樣。
Q45: 持續安定性試驗是否可用虐待性試驗 方式加速完成?
A45: 否,持續安定性試驗之目的係為確定在有效期限全期,且在其所標示的儲存條件下, 該產品的品質仍可維持在其規格內,並同時監測是否有其餘安定性之問題,與上市前 安定性試驗目的不同,故不應用虐待性試驗方式取代持續安定性試驗。
